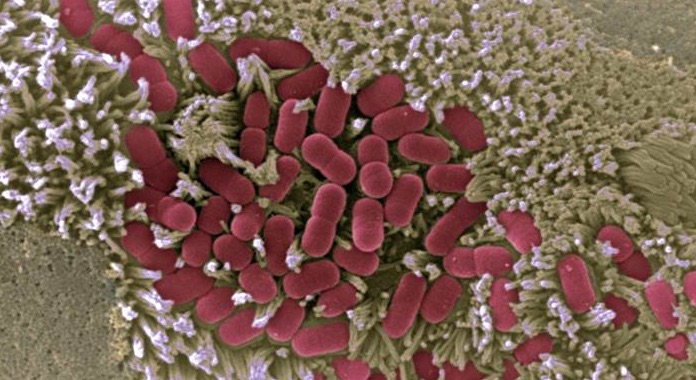
Un estudio en el que han participado científicos del Consejo Superior de Investigaciones Científicas (CSIC) ha logrado descifrar la forma en la que las bacterias patógenas, como Salmonella y Escherichia coli, usan redes de proteínas para controlar a las células durante una infección. Los resultados del trabajo, que han sido publicados en la revista Science, podrían ayudar a mejorar el diseño de vacunas y otros tratamientos frente a estos patógenos.
Muchas de las bacterias que producen enfermedades introducen proteínas maliciosas, denominadas efectores, en la célula, con las que reprograman sus funciones para beneficiar la infección. Los efectores toman el control de las células para, por ejemplo, evitar que se envíen señales de alarma al sistema inmune y así permitir a los intrusos colonizar el intestino.
“Los antibióticos son poco eficaces para combatir a estas infecciones ya que eliminan la flora bacteriana intestinal beneficiosa, la microbiota, y pueden acabar ayudando a las bacterias patógenas a colonizar el intestino. Por lo tanto, sigue siendo un reto encontrar tratamientos efectivos para estas infecciones y, para ello, es clave comprender cómo funciona el proceso infectivo”, explica el investigador del CSIC Luis Ángel Fernández, del Centro Nacional de Biotecnología (CNB-CSIC).
Pero esto no es tarea sencilla. Las bacterias patógenas cuentan con una gran variedad de efectores distintos y estos se apropian de la célula a través de interacciones complejas. A causa de esta complejidad, hasta ahora no se había estudiado cómo estas proteínas efectoras trabajan conjuntamente durante la infección. Científicos españoles en el CSIC, la Universidad Politécnica de Madrid y el Imperial College de Londres han aunado fuerzas para llevar a cabo la titánica labor de analizar las proteínas efectoras de un patógeno intestinal de forma conjunta. Para conseguirlo, ha sido necesario combinar experimentos en el laboratorio con herramientas de inteligencia artificial (IA).
En este trabajo han utilizado una bacteria que infecta ratones (Citrobacter rodentium) pero que está emparentada con las cepas de E. coli que infectan en el intestino humano. Mediante ingeniería del genoma de esta bacteria, han construido más de 100 variantes (cepas), cada una con una combinación diferente de efectores. En el laboratorio, han investigado los efectos que provocan las distintas variantes en las células infectadas del intestino del ratón y en la respuesta del sistema inmune, y han clasificado estas variantes según su capacidad de colonizar el intestino.
En este estudio se ha descubierto que los efectores cooperan entre ellos formando redes en las que existen funciones solapantes, de forma que las bacterias pueden salirse con la suya incluso cuando carecen de más del 60% de las proteínas efectoras. Además, gracias a la ayuda de la IA, se ha podido identificar que cada red se caracteriza por tener distintas proteínas efectoras esenciales.
David Ruano Gallego, investigador actualmente en el Centro de Astrobiología (CSIC-INTA), y Julia Sánchez Garrido, investigadora española en el Imperial College de Londres, coinciden en que los resultados muestran que los efectores inyectados no actúan individualmente sino cooperando y que la red que forman es resistente y flexible a la vez; si varias piezas fallan, las demás todavía son capaces de hackear a la célula. “Si aprendemos cómo actúa cada conjunto particular de estas moléculas bacterianas para establecer una infección, podremos diseñar tratamientos individualizados”, apunta Ruano.
Según David Ruano, “estos resultados también abren la posibilidad de utilizar la información de la IA para comprender mejor otras enfermedades intestinales como la colitis o el cáncer. También, encontraremos formas alternativas de combatir las infecciones sin tener que usar antibióticos, sino mejorando y ayudando a nuestras propias defensas”.
CSIC Comunicación