Entrevista > Lucía Cocera Ortega / Investigadora (Utiel, 1-abril-1990)
Lucía Cocera ha contribuido a grandes avances en la investigación relacionada con las células del corazón gracias a sus trabajos desarrollados en Países Bajos. A pesar de la distancia, la investigadora en el campo de biotecnología no olvida sus orígenes utielanos, los cuales afirma echar mucho de menos, demostrando que en el suyo, su corazón, lleva Utiel allá donde esté.
¿Cómo se despertó en ti la vocación científica?
Fue ya desde el colegio. Fue en la ESO que nos explicaron un poco más de genética, cómo funciona la herencia, cómo recibes características de tus abuelos o padres, cómo se puede predecir entendiendo el ADN. Me fascinó y me puse a buscar qué carreras había para investigar más la parte genética. Durante bachiller, todo parecía encaminarme hacia Medicina.
¿Y de qué manera surgió el cambio hacia la Biotecnología?
Lo que me gustaba era entender más a nivel celular qué les pasa a las células, cómo funciona el ADN, la genética, cómo se pueden desarrollar nuevas terapias, en lugar de quizá entender si este paciente tiene estos síntomas. Me di cuenta que esa parte era la que más me gustaba. Mucha gente se sorprendió de la decisión en el último momento, pero no me he arrepentido nunca de haber elegido biotecnología.
«Nuestra investigación se centra en la enfermedad que ocurre después de un infarto al corazón»
¿Qué te llevó a Países Bajos?
Hice un Erasmus y prácticas durante la carrera en Alemania. Me fui sin casi saber inglés, a la aventura total, y me gustó un montón. Tenía muy claro que quería investigar y hacer doctorado y en España, poco después de la crisis, la cosa estaba fatal. Eso fue lo que me hizo buscar oportunidades en el extranjero para comenzar mi carrera como investigadora.
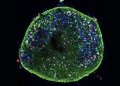
Tu trabajo se centra en la regulación génica, biología molecular y enfermedades cardiovasculares. ¿Podrías explicarlo?
Se centran en la enfermedad que ocurre después de un infarto al corazón llamada cardiopatía isquémica. Cuando tienes un infarto, parte del tejido muscular del corazón deja de recibir sangre y oxígeno y millones de células mueren. Una particularidad de las células del corazón es que no son capaces de dividirse y regenerar la parte dañada del corazón.
Por ejemplo, imagina que tienes una herida en la piel, las células se dividen y regeneran esa herida y al final, no tienes la herida. Pues en el corazón esto no pasa.
«Tienes que encontrar una manera de diseñar proyectos que tengan impacto»
¿Cuáles son las consecuencias?
Lo que ocurre es que, como las células del corazón no son capaces de dividirse, se produce como una cicatriz, y esto hace que, a la larga, no pueda latir con la fuerza necesaria y durante un tiempo, como que intenta compensar. Al final, acaba no siendo capaz de bombear sangre suficientemente al cuerpo.
Esto compromete enormemente la calidad de vida de estos pacientes que tienen que tomar medicación de por vida y nunca llegan a recuperarse totalmente. Al final estos tratamientos solamente tratan los síntomas de la enfermedad pero no la curan y la única opción al final es un marcapasos o directamente necesitan un trasplante de corazón.
¿Cómo se puede solucionar?
Nosotros estamos desarrollando una terapia experimental para el corazón que usa unos virus especiales llamados AAVs (que son seguros y se usan como herramientas médicas). Dentro de estos virus ponemos pequeñas moléculas llamadas miARNs (microARNs), que actúan como mensajeros para activar procesos naturales de regeneración en el corazón.
La idea es que, después de un daño como un infarto, el corazón normalmente no puede repararse bien solo. Pero con esta terapia, los miARNs ayudan a ‘despertar’ las células del corazón o a crear un entorno que favorezca su reparación, como si empujáramos al corazón a sanarse por sí mismo.
«No me he arrepentido nunca de haber elegido biotecnología»
Además, has contribuido a estudios sobre terapias basadas en ácido ribonucleico (ARN) para tratar mutaciones genéticas en el corazón ¿Tiene relación con tu trabajo actual?
Es vinculado porque justamente la terapia que estamos desarrollando ahora también se basa en ARN, aunque la otra es para enfermedades en pacientes que tienen una mutación. Durante ese estudio vimos variaciones en el ADN que podían hacer que el paciente estuviera menos afectado, y desarrollamos la terapia con el ARN para silenciar o eliminar la proteína que tenía esa mutación.
Con tanto trabajo detrás, ¿el mayor reto acaba siendo el conseguir financiación?
Tienes que diseñar un proyecto y convencer a los organismos que dan financiación de que ese proyecto tiene sentido, merece la pena, es ambicioso, pero no es poco realista. Es un reto, pero es también algo bueno, porque tienes que encontrar una manera de diseñar proyectos que tengan impacto.
Personalmente, aunque reconozco que es un reto, lo veo como parte esencial del trabajo como investigadora. He tenido la suerte de recibir financiación de varias entidades, lo cual me ha permitido llevar a cabo mis investigaciones, y estoy muy agradecida por esas oportunidades.
Dicho esto, creo firmemente que es necesario invertir más en investigación. La ciencia requiere tiempo, recursos y estabilidad, y si queremos avanzar en áreas clave como la salud, necesitamos un mayor compromiso con la financiación científica a largo plazo.