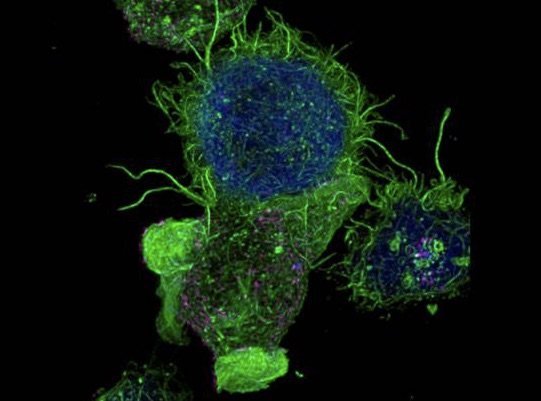
Un estudio con participación de investigadores del Consejo Superior de Investigaciones Científicas (CSIC) ha mostrado las bases moleculares de un proceso clave de la respuesta inmune: cómo se regula la reorganización del citoesqueleto de actina en la conexión sináptica entre los linfocitos T –células inmunitarias que combaten los patógenos- y las células infectadas. El estudio ha comprobado que en esta conexión juega un papel clave la actina filamentosa, un armazón o andamiaje similar a una malla presente en el interior de los linfocitos T, que se reorganiza para regular el tráfico secretor de vesículas (que transmiten información biológica) en la conexión sináptica hacia la célula infectada, y permitir así la respuesta inmune (la acción de los linfocitos T para eliminar la célula infectada).
El estudio, publicado en la revista Journal of Extracellular Vesicles, permite conocer mejor cómo es la relación molecular de la conexión sináptica de los linfocitos T con las células infectadas y podría servir para desarrollar nuevas estrategias con posible interés terapéutico frente a patógenos como virus y bacterias.
La respuesta inmune celular que ejercen los linfocitos T es fundamental en la lucha del organismo frente a patógenos. Las vacunas más efectivas son aquellas capaces de inducir una respuesta inmune eficiente y duradera, tanto humoral (activación de linfocitos B y producción de anticuerpos) como celular (activación de linfocitos T y generación de linfocitos T de memoria) en el organismo inmunizado. Los linfocitos T de memoria “recuerdan al patógeno” y cuentan con un receptor capaz de reconocer al antígeno del patógeno (que, por ejemplo, puede ser un virus) la siguiente vez que se produzca una infección para eliminar la célula infectada.
“Conocer las bases moleculares que regulan la actividad de los linfocitos T específicamente dirigidos contra patógenos es clave para favorecer y modificar su respuesta”, explica Manuel Izquierdo, investigador del CSIC en el IIB-CSIC-UAM.
“En este estudio hemos observado que aumentando la secreción polarizada de exosomas (vesículas extracelulares con cargas moleculares diversas) en los linfocitos T mediante la activación de la proteína PKCdelta, se puede aumentar la actividad de los linfocitos T que eliminan células infectadas por patógenos virales y favorecen la respuesta inmune celular frente a estos patógenos”, apunta Izquierdo. Los exosomas son vesículas extracelulares que transmiten información biológica (muerte, regulación génica) a otras células y a distancia.
“Pero este aumento de secreción -añade el investigador- también puede favorecer la muerte por activación (suicidio) de los linfocitos T, lo que en algunos casos puede ser útil, porque contribuiría a limitar una respuesta inmune excesiva e inhibir el desarrollo de ciertas enfermedades autoinmunes”.
Reorganización de actina
Cuando el linfocito T reconoce el antígeno (una molécula o estructura molecular típica de un patógeno) presente en una célula presentadora de antígeno, induce la formación de la sinapsis o conexión inmunitaria. A continuación, se activa la proteína PKCdelta, que a su vez activa dos proteínas clave que regulan el ensamblaje y desensamblaje del citoesqueleto de actina (parte del armazón o andamiaje interno de la célula) y reorganizan la distribución de la actina filamentosa, o “malla”, en el linfocito T.
De este modo, la actina filamentosa se reorganiza en dos zonas: una en el centro del linfocito T rodeando el centrosoma y otra en la zona de la conexión sináptica con la célula infectada. La malla de actina de la zona central actúa impidiendo el movimiento del centrosoma, mientras que en la zona de la conexión sináptica se abre un hueco en la malla para permitir que las vesículas de secreción capaces de liberar exosomas se concentren en esa zona.
“La malla de actina filamentosa actuaría como la manga de un pastelero. Al apretar la manga por un extremo, los cuerpos multivesiculares (que serían la crema) se dirigen hacia la zona de la conexión sináptica del linfocito T desprovista de actina filamentosa (que sería la boquilla abierta de la manga). De este modo, las vesículas o cuerpos multivesiculares se dirigen hacia la célula que presenta el antígeno (que sería el pastel), facilitando la secreción de exosomas (vesículas extracelulares) en el hueco de la conexión sináptica con la célula infectada”, señala el científico.
“Sin embargo, cuando la proteína PKCdelta está interferida, no se produce la activación de las dos proteínas que regulan la formación del citoesqueleto de la actina, por lo que no se reorganiza la malla de actina filamentosa centrosomal ni la sináptica. En ese caso no se puede producir la secreción de exosomas”, concluye.
El trabajo, realizado en colaboración con el Imperial College London (Reino Unido), cuenta con financiación de los fondos del Ministerio de Asuntos Económicos y Transformación Digital y el Plan Estatal de Investigación Científica y Técnica y de Innovación.
CSIC Comunicación