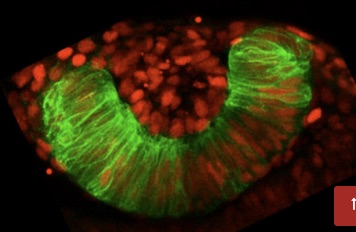
La visión depende de la interacción intima entre dos tejidos. La retina neural, con capacidad fotorreceptiva, y el epitelio pigmentado, que mantiene la homeostasis de los fotorreceptores reciclando activamente membranas y pigmentos visuales. La degeneración de cualquiera de estos dos elementos conduce a procesos de ceguera progresiva, contra los cuales las terapias de reemplazo celular son una promesa de futuro. Para progresar en el desarrollo de estas terapias es imprescindible entender en profundidad las redes genéticas que, durante el desarrollo, especifican ambos tipos celulares.
A eso se han dedicado investigadores del Centro Andaluz de Biología del Desarrollo (CABD) y del Centro de Biología Molecular Severo Ochoa (CBM), en colaboración con otros centros como el Centro Andaluz de Biología Molecular y Medicina Regenerativa (Cabimer), centro mixto del Consejo Superior de Investigaciones Científicas (CSIC), la Junta de Andalucía, la Universidad de Sevilla y la Universidad Pablo de Olavide (UPO), y el Institute of Medical Research de Sydney, en Australia. En una publicación que aparece en la revista Nature Communication han identificado las instrucciones genéticas clave para la construcción del denominado esbozo ocular.
“En este trabajo combinamos técnicas de secuenciación masiva (ARN-seq y ATAC-seq), para interrogar ambas redes genéticas en nuestro organismo modelo, el pez cebra. Nuestros estudios se centran en la bifurcación temprana de las dos redes a partir de una única red, la presente en precursores inmaduros. Entre los resultados más notables destaca la caracterización de los motivos principales de unión al ADN que dirigen la diferenciación del epitelio pigmentado reprimiendo la de la retina neural y viceversa”, afirma Juan Ramón Martínez Morales, investigador principal del estudio y miembro del Grupo de Investigación Regulación Génica y Morfogénesis del CABD, un centro mixto del CSIC, la Universidad Pablo de Olavide y la Junta de Andalucía. Así mismo, el investigador añade: “Descubrimos que la identidad del epitelio pigmentado depende de dos ondas consecutivas de regulación transcripcional. Especialmente relevante es el hallazgo de que la misma lógica regulatoria puede extrapolarse a células humanas en diferenciación a pigmentario. Esta observación abre la puerta a la optimización de este tipo de cultivos para su uso en terapia celular paliativa de las enfermedades neurodegenerativas del ojo”.
Por su parte, la coautora del estudio, Paola Bovolenta, del CBM ─ un centro mixto del CSIC y la Universidad Autónoma de Madrid (UAM) ─ indica que “el estudio proporciona mucha información que nos permitirá estudiar en profundidad similitudes y también diferencias entre los mecanismos genéticos que regulan el crecimiento del ojo entre distintas especies. El ojo de un pez crece durante toda la vida y esto podría proporcionar más claves sobre cómo recuperar esta capacidad en caso de enfermedades neurodegenerativas”.
Esta investigación proporciona una gran cantidad de información genética que podrá ser explotada no solo en vista de posibles terapias ante cegueras hereditarias progresivas, sino también como fuente de información para buscar genes que puedan ser causa de enfermedades genéticas con un fenotipo ocular y que todavía carezcan de un diagnóstico molecular preciso.
CSIC Comunicación Andalucía y Extremadura