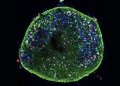
Científicas del Instituto de Ciencia de Materiales de Madrid (ICMM-CSIC) han desarrollado una técnica de medición directa de la temperatura de nanopartículas en el interior de células tumorales humanas a través de rayos X. Con esto, se podrán diseñar terapias más precisas y menos tóxicas para el tratamiento del cáncer mediante la hipertermia, técnica que busca curar los tumores a través del aumento de su temperatura.
La hipertermia suele acompañar a la radio y la quimioterapia en el tratamiento clínico contra el cáncer. Su uso utilizando nanopartículas generadoras de calor (en el rango de la milmillonésima parte de un metro) ofrece múltiples ventajas, aunque la medición de temperatura en esa escala (conocida como nanotermometría) representa un gran reto. Es ahí donde este trabajo marca un hito. Para que funcione la nanotermometría es esencial poder medir y monitorizar la temperatura de las nanopartículas internalizadas en las células tumorales y saber cómo éstas reaccionan a dichas temperaturas. “El reto es conseguir termómetros nano que sean sensibles y robustos en el medio biológico y que sean operativos en un amplio rango de temperatura”, explica Ana Espinosa, investigadora del ICMM-CSIC y autora principal del estudio, junto a Álvaro Muñoz Noval, de la Universidad Complutense de Madrid (UCM).
Hasta ahora, para estas mediciones se usan técnicas ópticas muy precisas basadas en la fluorescencia de ciertas partículas añadidas, pero este equipo ha logrado un paso más allá al explorar una nueva técnica de rayos X que permite la medición directa de la temperatura dentro de las células que se estudian, sin necesidad de marcadores adicionales. Por un lado, las nanopartículas reciben calor a través de una luz en el infrarrojo cercano, mientras que, por otro, se usan rayos X para observar ese aumento de temperatura y su efecto en la célula.
“Es un método de medición directo: los átomos vibran y se calientan, lo que es captado por los rayos X sin necesidad de otra partícula que refleje ese cambio en la temperatura”, indica Espinosa, que señala que, aunque para el trabajo se han utilizado nanopartículas de oro y de óxido de hierro combinadas, éstas podrían ser de otro tipo de material.
Un termómetro nanométrico universal
El resultado clave de este estudio ha sido la observación de cómo, al aplicar calor en estas condiciones, las temperaturas a nivel nanoscópico son más altas que a nivel macroscópico, lo que será clave para diseñar terapias más precisas y menos tóxicas en todos los sentidos: se podrá disminuir la temperatura que se aplica a las células y por tanto la potencia del láser, serán necesarios menos nanopartículas y el tratamiento podrá durar menos.
Además, este termómetro nanométrico puede ser utilizado de forma universal, pues podrá aplicarse a cualquier otro proceso que requiera de temperatura, como en la microelectrónica y la catálisis, entre otros: “Opera eficazmente en un amplio rango de temperaturas, convirtiéndose en una herramienta versátil para estudiar fluctuaciones térmicas en general”, defiende la investigadora.
Dada la alta sensibilidad que necesitaban para el estudio, las mediciones se han realizado en la línea SAMBA en el sincrotrón SOLEIL (Saint-Aubin, Francia), aunque el objetivo es poder realizarlo en un futuro con instrumentación de laboratorio. El trabajo, publicado en la revista Advanced Healthcare Materials, ha usado un modelo tumoral 3D in vitro de un glioblastoma (un tipo de cáncer cerebral).
Este estudio es una colaboración entre investigadores de diversos centros: IMDEA Nanociencia (España), BCMaterials (España), sincrotrón Soleil (Francia), Instituto Curie (Francia), Instituto de Cerámica y Vidrio (ICV-CSIC, España), Instituto de Ciencia de Materiales (ICMM-CSIC, España) y la Universidad Complutense de Madrid (España).