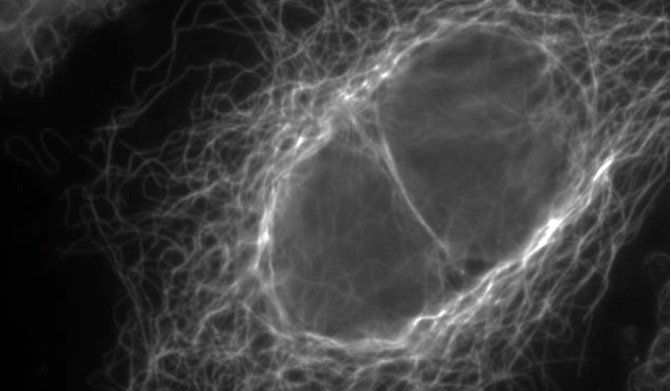
Los microtúbulos, unos filamentos formados con la proteína tubulina, están presentes en todas nuestras células; regulan su forma, funcionan como carreteras para el transporte en su interior y dirigen la herencia del material genético durante la división. Estas características convierten a los microtúbulos en una diana para el tratamiento del cáncer. Ahora, un equipo liderado por el Consejo Superior de Investigaciones Científicas (CSIC) propone en la revista eLife una nueva teoría sobre la estructura de los extremos de estos microtúbulos. Las conclusiones del estudio abren una nueva vía en la búsqueda de compuestos más eficientes y que produzcan menos efectos secundarios en el tratamiento del cáncer, especialmente en el sistema nervioso.
“La estructura de los microtúbulos es heterogénea, especialmente en sus extremos. Y estos extremos son claves, además, en el funcionamiento de los filamentos, sobre todo como maquinarias no estáticas dentro de las células. Por eso nuestro objetivo era conocer cómo son los extremos de los microtúbulos bajo diferentes condiciones”, explica Marian Oliva, investigadora del CSIC en el Centro de Investigaciones Biológicas Margarita Salas. “A partir del estudio de diferentes modelos de filamentos, tanto a través de técnicas estructurales de alta y media resolución como con técnicas clásicas de bioquímica, hemos propuesto un modelo mucho más avanzado que los anteriores. Nuestro modelo puede explicar cómo proteínas reguladoras reconocen específicamente el extremo y colaboran en que los microtúbulos funcionen correctamente”, añade la científica.
Las conclusiones del estudio aportan además una nueva visión sobre cómo actúan agentes estabilizadores de microtúbulos que se usan en un amplio abanico de tratamientos contra el cáncer de mama, ovario y pulmón, entre otros. “Tras ciclos sucesivos de tratamiento, los pacientes suelen desarrollar neurotoxicidad periférica, que está íntimamente relacionada con la función del microtúbulo. El paclitaxel, uno de los medicamentos más usados en el tratamiento del cáncer, y otros estabilizantes amplifican una señal que solo se produce en una región minúscula del extremo del microtúbulo. Esta se extiende a todo el filamento, lo que dificultaría el movimiento de los transportadores que se mueven por estas carreteras moleculares, alterando las conexiones nerviosas. Esto se traduce en molestias u hormigueos en las piernas y las manos de los pacientes”, apunta la experta del CSIC.
“Ahora nos centraremos en buscar nuevos medicamentos que tengan el mismo efecto estabilizador pero que no afecten a las señales intrínsecas de estos filamentos”, añade la científica. Según los investigadores, conocer en detalle cómo son los microtúbulos y la relación que existe entre su estructura y las funciones que desempeñan es clave para desarrollar nuevos compuestos más eficaces, precisos y, sobre todo, seguros en el tratamiento del cáncer.
Estévez-Gallego J, Josa-Prado F, Ku S, Buey RM, Balaguer FA, Prota AE, Lucena-Agell D, Kamma-Lorger C, Yagi T, Iwamoto H, Duchesne L, Barasoain I, Steinmetz MO, Chretien D, Kamimura S, Díaz JF y Oliva MA. Structural model for differential cap maturation at growing microtubule end. eLife. DOI: 10.7554/eLife.50155
María González / CSIC Comunicación